Óscar Miguel Rivera Borroto & col.
534
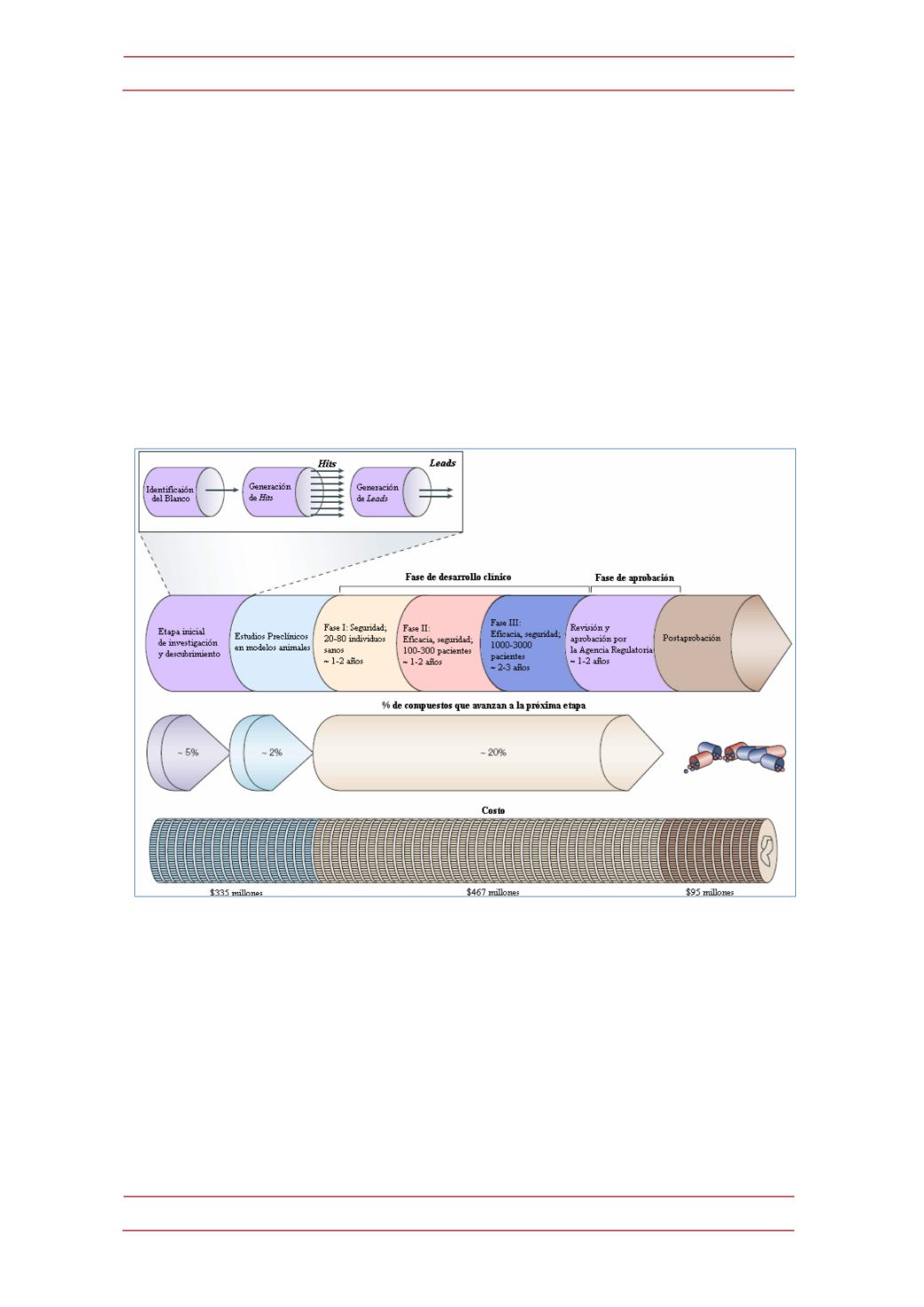
• Fase III (2 a 3 años): Finalmente, el estudio se completa con la realización
de pruebas de eficacia a gran escala, las que involucran una muestra mucho mayor
de personas (miles) de diferentes áreas demográficas.
Eventualmente, una vez previstos los resultados de este estudio clínico y
concedida la aprobación gubernamental, entonces puede comenzar la explotación
comercial del fármaco. La aprobación gubernamental es concedida, por ejemplo,
por la Administración de Alimentos y Medicamentos (FDA, del inglés Food and
Drugs Administration) en los Estados Unidos de América, por la Agencia Europea
de Medicamentos (EMA, del inglés European Medicines Agency) en la comunidad
Europea, por la Agencia Española de Medicamentos y Productos Sanitarios
(AEMPS) en España o para el caso particular de Cuba por el Centro para el Control
Estatal de la Calidad de los Medicamentos (CECMED).
Figura 2.-‐
Representación esquemática general del proceso de descubrimiento y desarrollo de
fármacos.
Un estudio relativamente reciente llevado a cabo por el
Boston Consulting
Group
(BCG) y que involucró a 50 compañías e instituciones académicas, mostró
que el coste de desarrollo de un nuevo medicamento desde la identificación de su
diana farmacológica, el descubrimiento y optimización de uno de los nuevos
compuestos líderes, el desarrollo de los ensayos clínicos requeridos y su uso
autorizado en terapéutica es como promedio de 880 millones de dólares (USD) y se
necesita también como promedio un período de 15 años de investigación [ver
figura 2] (13)
1.4. Necesidad de nuevos paradigmas


