CECILIO GIMÉNEZ
438
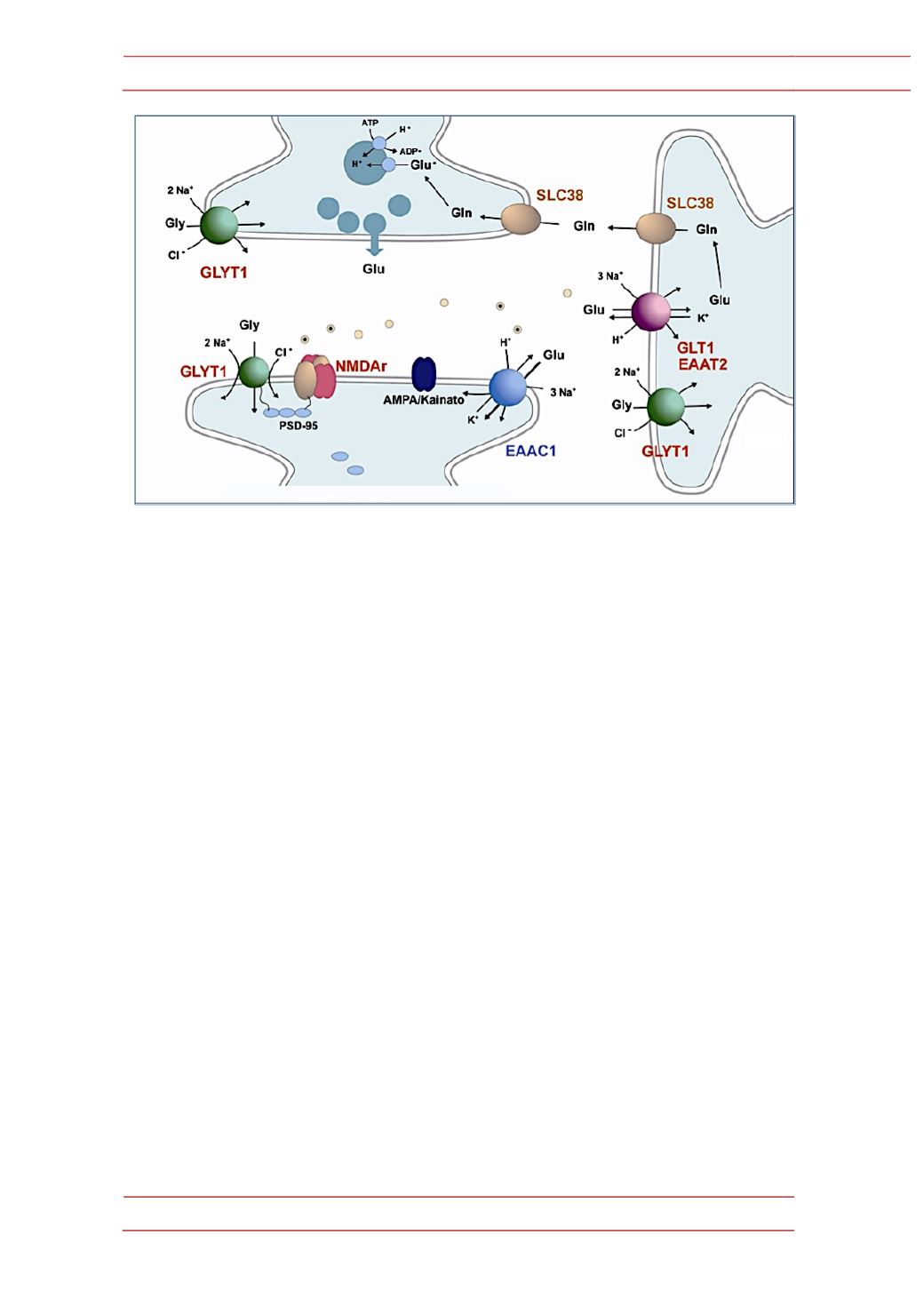
Figura 8.-‐
Esquema de una sinapsis glutamatérgica. Están representadas algunas de las proteínas
típicas de este tipo de sinapsis. GLYT1, transportador de glicina. GLT1, transportador de glutamato.
Receptores e glutamato del tipo AMPA y NMDA.
Nuestro grupo, junto con un grupo noruego, describió hace años la
distribución regional y celular de los transportadores de glicina (60, 61).
Concretamente, la proteína GLYT1 parecía ser exclusivamente de origen glial
frente a nuestro anticuerpo generado contra el extremo carboxilo de la proteína.
De cualquier manera, detectamos mensajeros de la misma en células neuronales.
Esta contradicción se aclaró diez años después tras generar un nuevo anticuerpo
contra el extremo amino de la misma.
A través de experimentos de inmunohistoquímica identificamos y
localizamos al transportador de glicina GLYT1 en elementos neuronales del
cerebro estrechamente relacionados a vías glutamatérgicas (62). Por otra parte,
mediante microscopía electrónica pudimos hacer una localización ultraestructural
de GLYT1. La tinción aparecía en terminales sinápticos de sinapsis asimétricas de
muchos elementos neuronales. Con técnicas de microscopía electrónica post-‐
embeding pudimos ver la acumulación de partículas de oro en densidades
postsinápticas y en zonas activas presinápticas.
Por otra parte, mediante estudios bioquímicos y de biología molecular y
celular demostramos la colocalización de GLYT1 y GLT1 con la proteína de
andamiaje PSD95 y a su vez con los receptores NMDA (63, 64). Experimentos de
microscopía confocal utilizando diferentes fluoróforos demostraron claramente la
interacción de GLT1 con PSD95 en espinas dendríticas. En estos trabajos no sólo
vimos la co-‐localización de estas proteínas con técnicas de biología celular, sino


