Sesión científica Premios Nobel 2012
137
derivados lipídicos, péptidos y proteínas en múltiples tejidos, que controlan
múltiples aspectos de la función celular y de la homeostasis del organismo
(Figura 2).
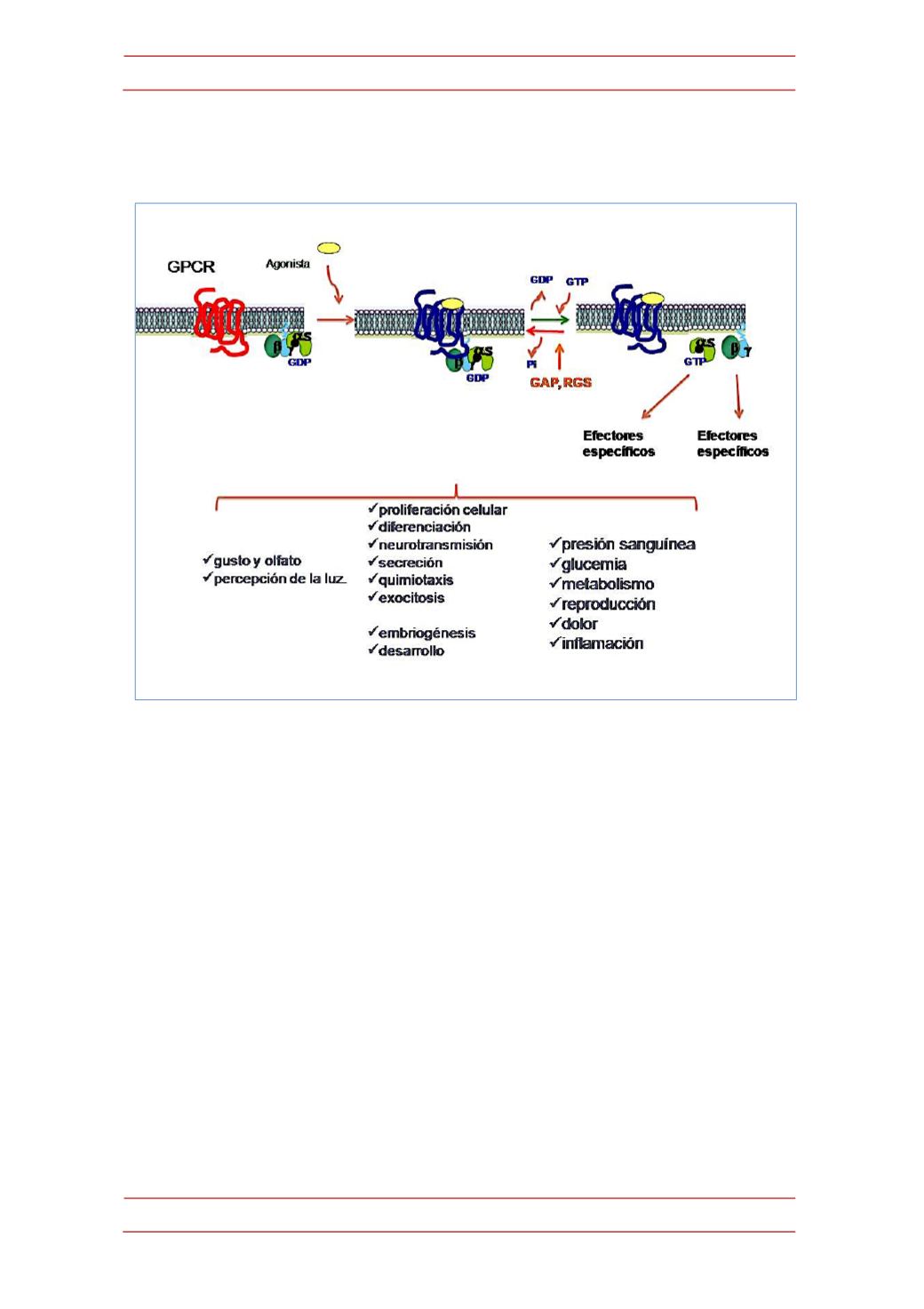
Figura 2.-‐
Señalización mediada por receptores acoplados a proteínas G. La llegada del agonista
promueve la interacción del receptor con la proteína G y el intercambio de GDP por GTP, lo que a su
vez conduce a la disociación de las subunidades de la proteína G heterotrimérica, que pueden
entonces interaccionar con efectores específicos y controlar una gran variedad de procesos
celulares básicos, la percepción sensorial y diversos aspectos de la homeostasis del organismo. La
activación de las proteínas G es transitoria, ya que su capacidad GTPasa (estimuladas por las
proteínas GAP o RGS) vuelve el sistema a su situación basal.
Las proteínas G son interruptores moleculares que se activan
transitoriamente. Estas proteínas pueden encontrarse en dos conformaciones
espaciales diferentes: una forma inactiva, cuando unen al nucleótido GDP, y otra
forma activada capaz de unirse con otras proteínas celulares denominadas
efectoras, cuando unen GTP. Pero esta activación es intrínsecamente transitoria, ya
que estas proteínas son GTPasas, es decir, destruyen al cabo de un breve tiempo el
GTP transformándolo de nuevo en GDP, y vuelven así a su estado basal. Tanto el
encendido (intercambio de GDP por GTP) como el apagado (hidrólisis de GTP) de
este interruptor molecular se pude modular por su interacción con otras proteínas.
Hoy sabemos que cuando los GPCR reconocen a su mensajero (por ejemplo,
el receptor de adrenalina a la adrenalina), cambian su conformación y pueden


