J. R. Lacadena y F. Mayor Menéndez
142
número de la revista Nature de mayo de 1986 (25). Sorprendentemente, el
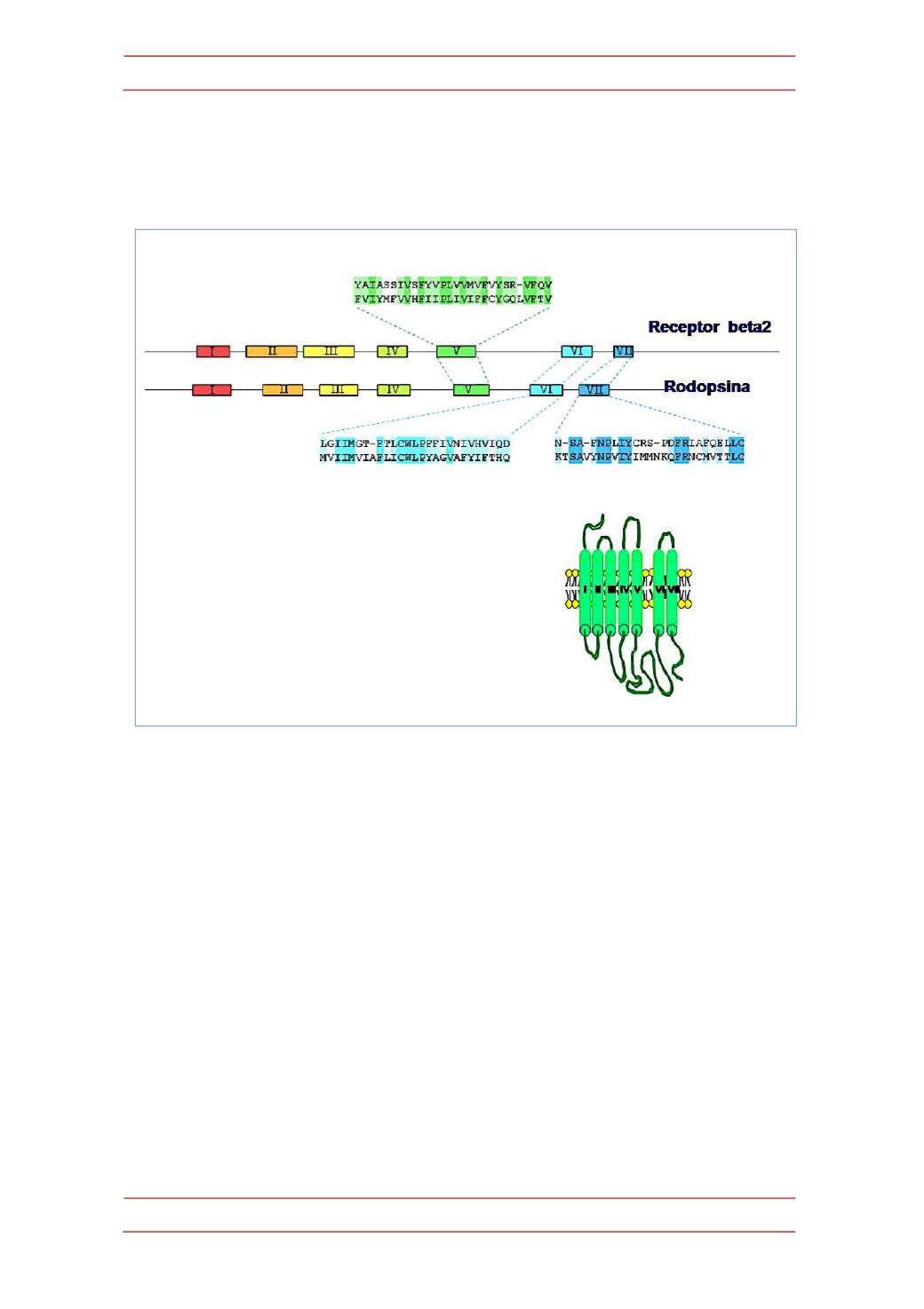
receptor de la adrenalina presentaba notables similitudes con el receptor de la luz
(la rodopsina), en el sentido de que ambos parecían presentar siete tramos de
aminoácidos capaces de atravesar la membrana celular (Figura 4).
Figura 4.-‐
Clonaje del receptor beta adrenérgico y concepto de familia de receptores acoplados a
proteínas G. El conocimiento de la secuencia del receptor beta-‐2-‐adrenérgico permitió su
comparación con la de la rodopsina e identificar similitudes en su estructura global y en la
secuencia de sus dominios transmembrana, lo que permitió proponer la existencia de una familia
de receptores de 7 dominios transmembrana con similares rasgos estructurales.
Al mismo tiempo, el laboratorio de Lefkowitz también descubrió que los
mecanismos de regulación del receptor de adrenalina eran muy parecidos a los de
la rodopsina de la retina. Se había descrito que en presencia de luz la rodopsina
activada se fosforilaba en su dominio intracelular por una enzima denominada
rodopsina quinasa, lo que promovía su desensibilización. También en 1986,
Benovic, Mayor, Caron y Lefkowitz publicaron un artículo en Nature (26) en el que
identificaban que una quinasa similar, denominada quinasa del receptor beta
adrenérgico (βARK por sus siglas en inglés) era capaz de fosforilar al receptor
beta-‐2 adrenérgico en respuesta a adrenalina, y también a la rodopsina en
respuesta a la presencia de luz (Figura 5).


