José Carlos Menéndez, Mercedes Villacampa
584
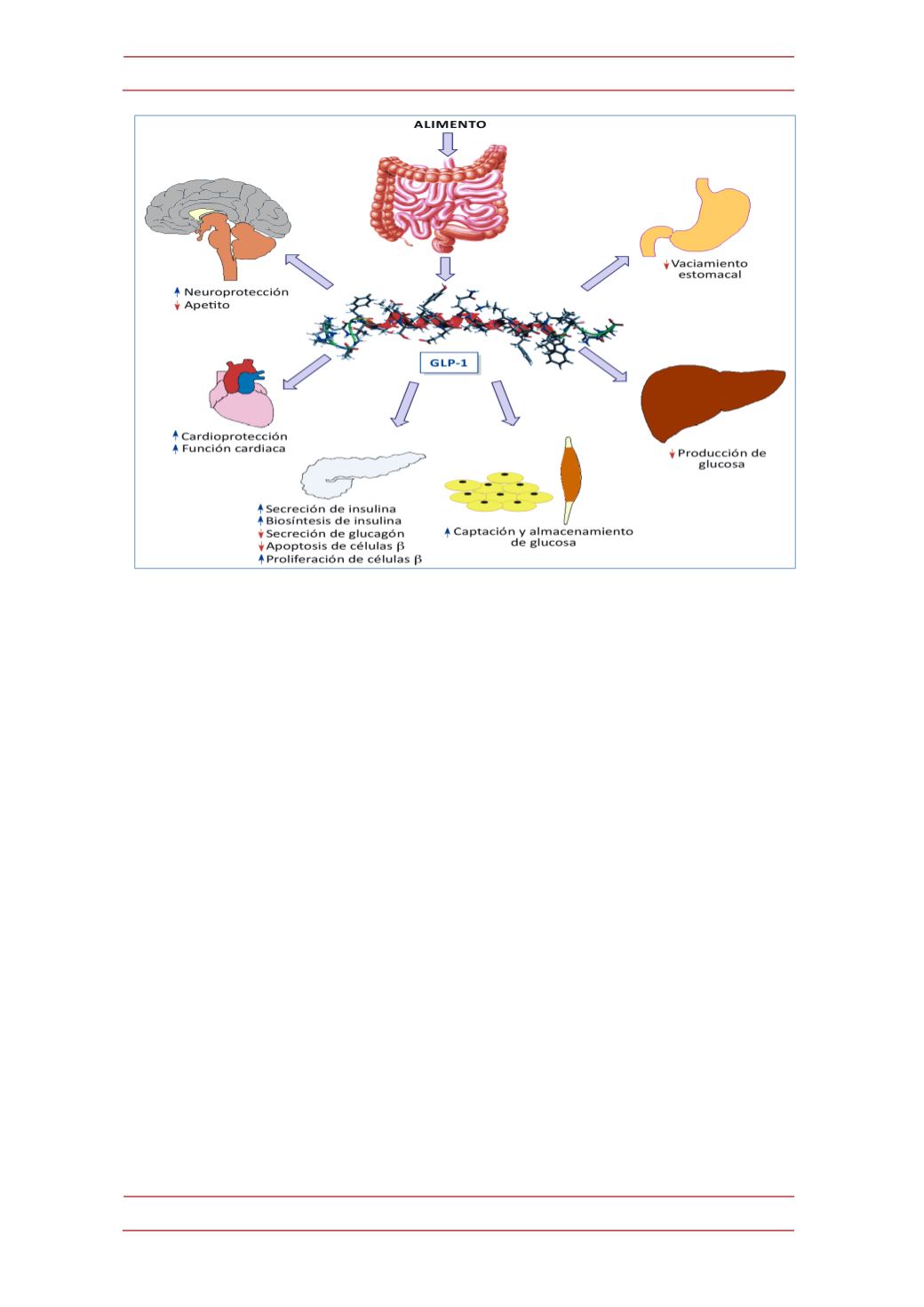
Figura 2.-‐
Principales efectos fisiológicos de la hormona GLP-‐1. La estructu
del
Protein Data Bank (1D0R, DOI:10.2210/pdb1d0r/pdb). Esta y todas las prot
en
figuras posteriores han sido descargadas del RCSB Protein Data Bank (
) y
visualizadas con la versión para Mac OSX de Avogadro 1.01 (7), salvo que se i
Existen dos estrategias principales para el diseño de fármacos
antidiabéticos basados en el aprovechamiento de la acción hipoglucemiante de las
incretinas (Figura 3). Por un lado, se están desarrollando agonistas del receptor de
GLP-‐1, que en la actualidad son péptidos análogos de la hormona natural.
El principal factor que condiciona su diseño es la extremadamente breve
semivida plasmática de GLP-‐1 (2 minutos, aproximadamente), que hace inviable su
empleo como fármaco. Esta fugaz duración de acción se debe a dos factores:
(a)
Una rápida eliminación renal, debida a su peso molecular
relativamente bajo.
(b)
Su metabolismo por la dipeptidil peptidasa IV (DPP-‐IV), que ataca el
extremo N-‐terminal de la hormona e hidroliza el fragmento formado por los dos
últimos aminoácidos. Resulta así el péptido GLP-‐1-‐(9–36)NH
2
, que es el que se
encuentra en mayor concentración en plasma y que tiene una afinidad 100 veces
menor por el receptor GLP-‐1r que la hormona completa.
Para superar estos problemas, se han sintetizado numerosos análogos
peptídicos de GLP-‐1 con modificaciones destinadas a superar estas limitaciones,
muchos de los cuales están inspirados en la estructura de la exendina 4, un péptido
natural que muestra resistencia a DPP-‐IV (11-‐14)


