José Carlos Menéndez, Mercedes Villacampa
586
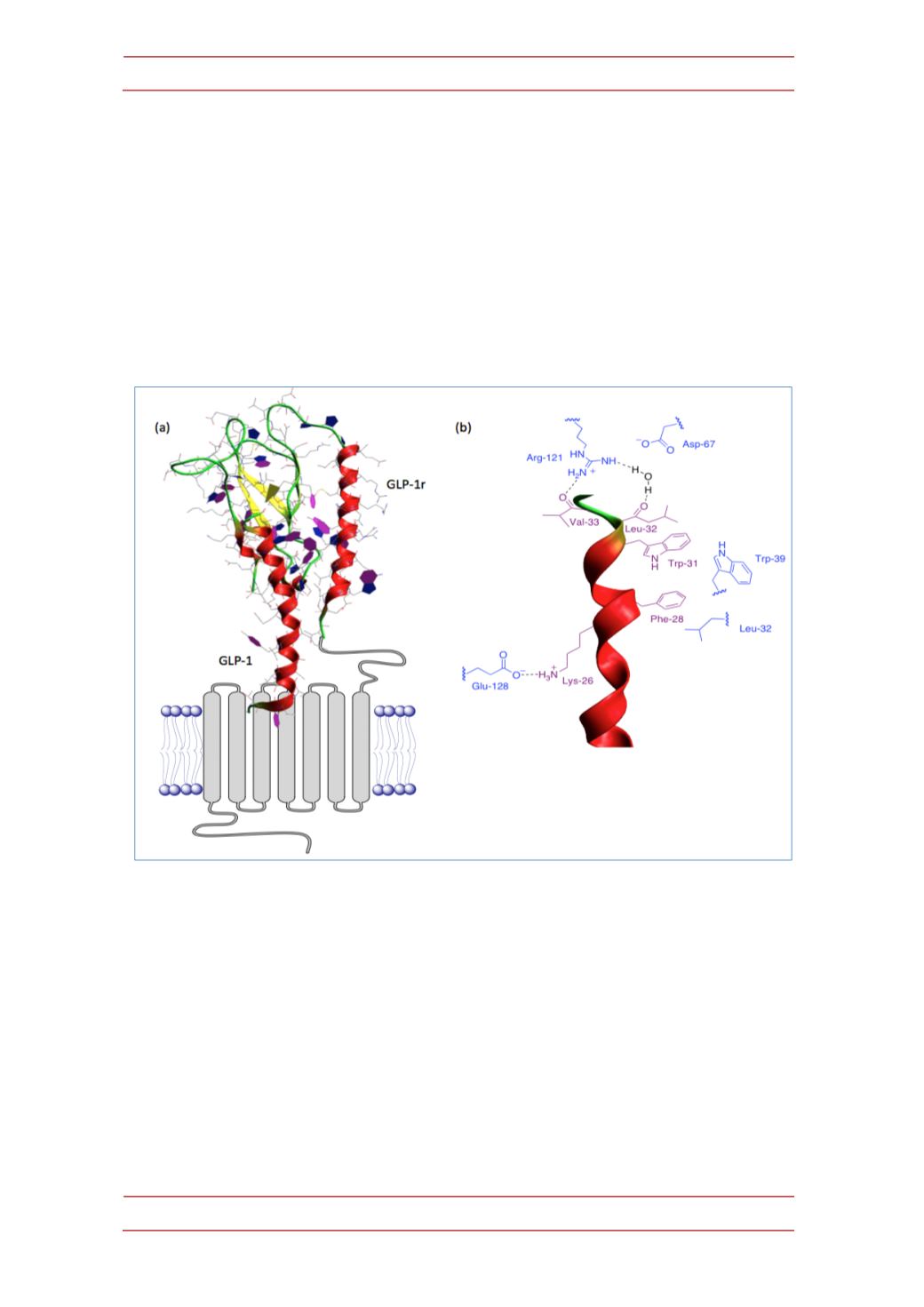
Se ha determinado por difracción de rayos X la estructura del complejo que
forman GLP-‐1 y el dominio extracelular de su receptor (18), que se muestra en la
Figura 5a. Las principales interacciones polares afectan a los residuos de leucina
32 y valina 33 de la hormona, que interaccionan con la arginina 121 del receptor a
través de sus grupos carbonilo pertenecientes al esqueleto del péptido, y a la lisina
26, que interacciona con el glutámico 128 del receptor. Además, son significativas
algunas interacciones hidrofóbicas que afectan a los residuos triptófano 31 y
fenilalanina 28 del péptido (Figura 5b). Cabe esperar que estos datos puedan
emplearse en el futuro como base para el diseño de agonistas no peptídicos del
receptor de GLP-‐1, un ámbito de investigación que está en sus inicios.
Figura 5.-‐
(a) Estructura esquemática del complejo formado por GLP-‐1 y la porción extracelular de
su receptor (pdb 3IOL, DOI:10.2210/pdb3iol/pdb). (b) Resumen de las principales interacciones
entre GLP-‐1 y su receptor (
¡Error! Marcador no definido.
).
2.2. Exenatida (exendina 4)
Existe otro péptido natural capaz de activar el receptor de GLP-‐1, la
exendina 4. Este compuesto se aisló de la saliva del lagarto
Heloderma suspectum
,
conocido como “monstruo de Gila” (Figura 6) (19). Se trata de una de las dos
especies conocidas de lagartos venenosos y habita zonas desérticas del sur de
Estados Unidos y el norte de México, tomando su nombre del valle del río Gila, en
Arizona, donde fue muy abundante. El monstruo de Gila se alimenta con muy poca
frecuencia (entre 5 y 10 veces al año, en su hábitat natural), y entre dos comidas
sucesivas tiene la capacidad de ralentizar su metabolismo y desactivar su páncreas.
Cuando llega el momento de alimentarse de nuevo, segrega la hormona exendina 4,


