José Carlos Menéndez, Mercedes Villacampa
602
Figura 21.-‐
Estabilización de las 2-‐cianopirrolidinas por introducción de sustituyentes
voluminosos.
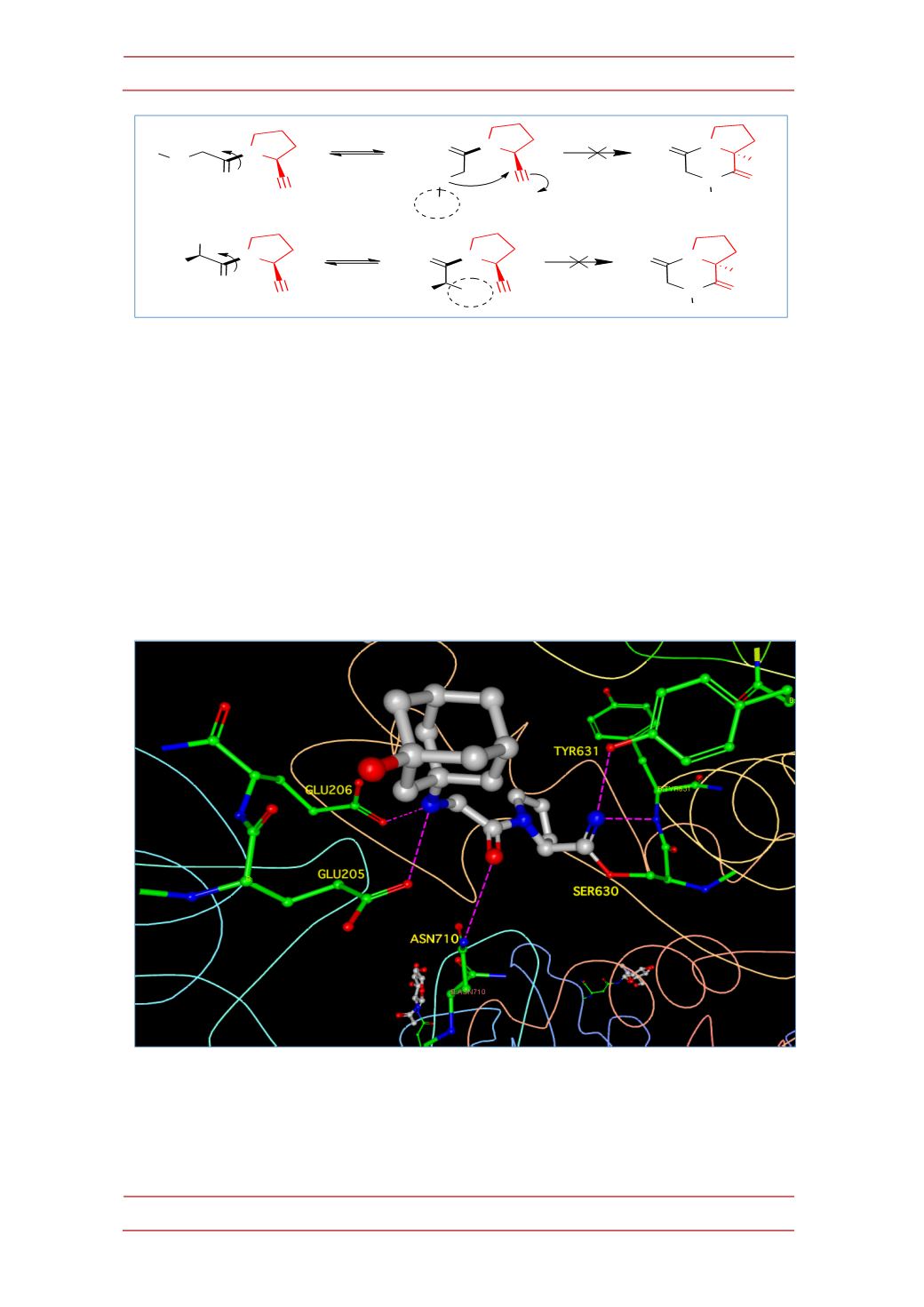
Las 2-‐cianopirrolilidinas se unen de manera covalente al sitio activo de la
DPP-‐IV mediante la formación de un imidato con el grupo OH de la Ser-‐630 que,
además, está estabilizado por un enlace de hidrógeno con la Tyr-‐547. A pesar de
ser covalente, esta unión es reversible debido a la baja estabilidad del imidato
frente a la hidrólisis. Además, el grupo amino, ionizado a pH fisiológico, establece
enlaces electrostáticos con los restos de Glu-‐205 y 206 (Figura 22). Los
aminoácidos implicados en la interacción son esenciales para la actividad de la
enzima, ya que el extremo N-‐terminal del péptido es fijado por interacciones con
Glu-‐205 y 206 y a continuación Ser-‐630 ataca como nucleófilo al penúltimo enlace
amídico del péptido.
Figura 22 (a).-‐
Interacciones de la vildagliptina con el sitio activo de DPP-‐IV. Representación
realizada con el programa Ligand Explorer a partir de una estructura de difracción de rayos X (pdb
3W2T).
N
N
O
N
H
R
N
N
O
HN
R
N
N
O
R
NH
H
N
N
O
H
2
N
R
N
N
O
H
2
N
N
N
O
R
NH
H
R
(a)
(b)


