109
celulares por los cuales la dieta rica en grasa inhibe la lipogénesis
de novo
en tejido
adiposo, puede proporcionar nuevas pistas de la patogénesis de la obesidad.
Por otro lado, la ausencia de correlación entre la ingestión de carbohidratos y el ritmo
de lipogénesis
de novo
en humanos, refuerza el concepto de que este tipo de lipogénesis
puede estar implicado en otras funciones fisiológicas independientes de su papel en la
economía energética de los macronutrientes. Aunque la mayor parte de las células tienen
capacidad de realizar la lipogénesis
de novo
, las células hepáticas y los adipocitos son las
mejor adaptadas. Un exceso de lipogénesis
de novo
en hígado ejerce efectos perjudiciales,
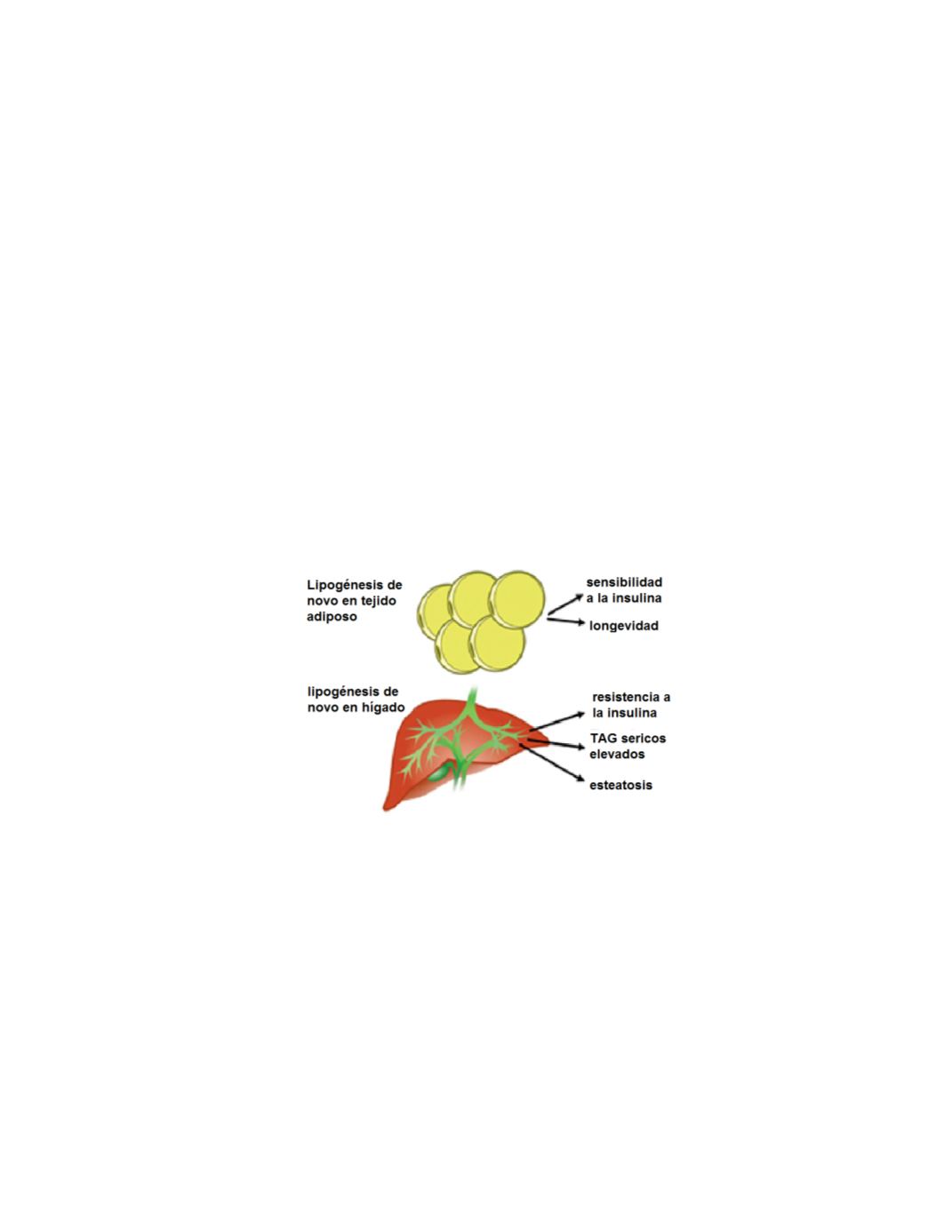
eleva los TAG séricos e incrementa los lípidos intrahepáticos (esteatosis), lo que conduce
al hígado graso y a las esteatohepatitis no alcohólicas (Figura 5). Además, la elevada
lipogénesis
de novo
hepática, se relaciona íntimamente con la resistencia la insulina,
mientras que la expresión incrementada de los enzimas lipogénicos en tejido adiposo, se
asocia con mayor sensibilidad a la insulina y con la longevidad.
Figura 5
. Consecuencias divergentes de la lipogénesis
de novo
en tejido adiposo comparado con la
lipogénesis
de novo
en hígado. La esteatosis se puede manifestar como hígado graso no alcohólico, o como
esteatohepatitis no alcohólica (Herman y Khan 2012, modificado)
Por tanto, los carbohidratos consumidos en cantidades superiores a los requerimientos
energéticos del organismo y por encima de la capacidad que tiene el hígado de
almacenarlos en forma de glucógeno, han de ser convertidos en ácidos grasos para su
almacenaje en forma de triacilglicéridos. El tejido adiposo blanco es el tejido primario que
se encarga de almacenar la grasa. Es importante destacar, que en hígado, la lipogénesis
de
novo
y la posterior síntesis de triacilglicéridos, debida a un elevado consumo de


